Alessandra Spazzoli1, Loretta Zambianchi1, Maria Francesca Lifrieri1, Stefania Cristino1, Emanuele Mambelli1, Marco De Fabritiis1, Claudio Americo1, Maria Laura Angelini1, Paolo Ferdinando Bruno1, Benedetta Fabbrizio2, Giovanni Mosconi1
1U. O. Nefrologia e Dialisi, Forlì-Cesena – AUSL della Romagna
2SSD di Diagnostica Istopatologica e Molecolare degli Organi solidi e del relativo Trapianto, Azienda Ospedaliero/Universitaria di Bologna
SCENARIO CLINICO
Uomo di 67 anni, giunto alla osservazione nefrologica nell’Ottobre 2019 per insufficienza renale ingravescente.
In anamnesi: nel Gennaio 2018 riscontro di LLC e da allora in follow up ematologico in assenza di indicazioni a trattamento (Stadio 0 RAI A Binet), ipertensione arteriosa complicata da cardiopatia ipertensiva, sindrome ansioso depressiva, pregressi interventi di ernia inguinale bilaterale ed ombelicale.
Il 16/10 giungeva alla nostra attenzione per un peggioramento severo della funzione renale con creatinina 4.76 mg/dl (eGFR 12 ml/min/1.73mq). All’analisi degli esami laboratoristici disponibili il paziente presentava una funzione renale nei limiti della norma fino a Settembre 2018. I successivi esami mostravano comparsa di alterazione della funzione renale con progressivo e rapido peggioramento funzionale (creat. 1.59 mg/dl Marzo 2019, 2.6 mg/dl Settembre 2019, 4.76 mg/dl Ottobre 2019) in assenza di eventi clinici significativi o uso di farmaci nefrotossici.
I restanti esami laboratoristici mostravano una leucocitosi 52860/mmc con linfocitosi (82%) in nota LLC (Settembre 2018 28430/mmc, Marzo 2019 32890/mmc), anemia moderata (Hb 10.5 g/dl) PLT 124000/mmc, glicemia 113 mg/d; entro i range gli elettroliti sierici e acido urico, LDH 288 U/L (lievemente aumentato), presenza di componente monoclonale IgM/lambda con immunofissazione positiva (0.7 g/L), Bence-Jones positiva per catene lambda, all’esame urine presenza di proteinuria fino a 30 mg/dl, glicosuria (50-100 mg/dl), kappa e labda aumentate (rispettivamente 33.4 mg/l e 93.5 mg/dl) con rapporto normale. PCR negativa (0.5 mg/l), lieve ANA positività (1:80), negativi crioglobuline, ENA, ANCA, antiGBM, complemento non consumato, immunoglobuline nella norma.
Una recente ecografia addominale mostrava splenomegalia (asse polo-polo 15 cm). Reni in sede nei limiti volumetrici senza segni di uropatia ostruttiva, prostata ingrandita di circa 50 cc di volume.
Veniva disposto ricovero in Nefrologia con programma di biopsia renale. Veniva ripetuta una ecografia addominale che confermava la splenomegalia e reni di dimensioni ed ecostruttura nei range; veniva evidenziata moderata asimmetria renale (rene dx di 9.5 cm e sin di 12 cm) con spessore parenchimale di 2.1 cm e conservata differenziazione corticomidollare e parenchimo-pielica. EcoColorDoppler negativo per stenosi arterie renali.
Gli esami ematici confermavano l’alterazione della funzione renale con presenza di proteinuria all’esame urine spot e glicosuria, come da interessamento tubulare; proteinuria delle 24 ore 0.86 g/die. Leucocitosi con 55000/mmc. Si confermavano negativi i principali esami immunologici.
I colleghi Ematologi, visionati i dati laboratoristici, ritenevano che dal punto di vista ematologico non vi fossero segni di progressione e tendevano ad escludere che il peggioramento della funzione renale fosse secondario alla malattia ematologica. Una biopsia del grasso peri-ombelicale risultava negativa, una PET total-body non evidenziava captazioni patologiche. Si era quindi in presenza di una significativa alterazione della funzione renale con segni di interessamento tubulare in paziente con leucocitosi con linfocitosi in nota LLC in aumento, ma in assenza di criteri ematologici di attività di malattia (tab. 1), minima componente monoclonale con proteinuria di Bence Jones positiva.
ERA POSSIBILE FORMULARE LE SEGUENTI IPOTESI
Componente monoclonale a significato renale: multiforme spettro di patologie renali (con interessamento di glomerulo, tubulo e/o interstizio) accomunate dal meccanismo patogenetico secondario alla paraproteina secreta da un disordine linfoproliferativo di basso grado. Il coinvolgimento organico è, in queste forme, prevalentemente renale, senza evidenza di interessamento midollare specifico e/o di presenza di tutti i criteri CRAB (ipercalcemia, insufficienza renale, anemia e lesioni ossee); per la diagnosi è fondamentale la biopsia renale.
Amiloidosi renale: gruppo di malattie caratterizzate dalla deposizione di fibrille rosso-congo positive a livello dei tessuti. Nell’amiloidosi associata a immunoglobuline, le fibrille consistono in catene leggere monoclonali (AL), catene pesanti monoclonali (AH) o entrambe (AHL)
Altro interessamento renale della malattia ematologica: MPGN IgG kappa e lambda, GN crescentica, GN da immunotattoidi, GN membranoproliferativa
Altra patologia non associata alla malattia ematologica
Veniva confermato il programma diagnostico e veniva effettuata biopsia renale; il paziente veniva dimesso in attesa del risultato dell’esame istologico. Al primo controllo ambulatoriale, dopo 5 giorni dalla dimissione, il paziente presentava un ulteriore peggioramento della funzione renale con creatininemia fino a 7 mg/dl (eGFR 7 ml/min/1.73mq) associato ad un aumento della leucocitosi (GB 70000/mmc) con linfocitosi (sempre >80%). Il successivo referto istologico preliminare mostrava “tessuto renale comprendente un infiltrato linfoide diffuso”, quadro suggestivo di localizzazione renale di linfoma. La valutazione ematologica segnalava “LLC apparentemente stadio 0 RAI A Binet che non avrebbe criteri di trattamento se non per una chiara correlazione tra insufficienza renale e malattia linfoproliferativa”. In attesa di tipizzazione definitiva dell’infiltrato linfoide, veniva iniziata terapia con steroide a dosaggio ematologico (desametasone 20 mg per 5 giorni, seguito da deltacortene 25 mg), con rapida risposta in termini d miglioramento della funzione renale (creat. 2.8 mg/dl) e della leucocitosi (GB 25000/mmc). La diagnosi istologica definitiva, dopo caratterizzazione istochimica, deponeva per una localizzazione renale di linfoma/leucemia di derivazione dei linfociti B periferici, tipo leucemia linfatica cronica/linfoma a piccoli linfociti (tab. 2). Attualmente il paziente è in carico all’Ematologia e in terapia con Ibrutinib; segue regolare follow-up nefrologico.
La malattia renale è una complicanza frequente dei disordini linfoproliferativo B cellulari, incluso mieloma multiplo (MM), macroglobulinemia di Waldenström (WM) e altri linfomi non Hodgkin (NHL).
L’incidenza del coinvolgimento renale alla diagnosi di linfoma è stata riportata tra il 2.7-6% dei casi. Sono presenti 2 principali meccanismi fisiopatologici che possono coesistere nello stesso paziente, cioè infiltrazione maligna del tessuto renale da parte di B clonali e/o tossicità delle Ig monoclonali secrete dal clone [1].
L’infiltrazione renale da parte di malattie ematologiche rappresenta un evento frequente dal punto di vista istopatologico: casistiche autoptiche riportano incidenza tra 35-70% dei casi. In particolare, la leucemia linfocitica cronica (LLC) è la patologia ematologica più frequentemente associata ad infiltrazione del parenchima renale con una prevalenza che varia dal 63% al 93%. [1-6]
Il linfoma renale può essere mono o bilaterale; è caratteristicamente presente un interessamento clinico minore in quanto la sintomatologia che porta alla diagnosi è in genere extrarenale ed è necessaria una estesa infiltrazione per indurre alterazioni funzionali o sintomi che portino all’evidenza specifica del coinvolgimento renale. La tipologia dell’infiltrazione parenchimale è variabile: i casi più frequenti presentano un aspetto multinodulare, mentre nel 20% è presente un’infiltrazione diffusa. L’infiltrazione diffusa è più facilmente studiata con indagine bioptica dal momento che può mimare una malattia renale c.d. “medica”, specie quando i sintomi sistemici del linfoma sono sfumati od assenti [1].
L’infiltrato linfomatoso può essere focale/nodulare, soprattutto nei linfomi di basso grado (come nel linfoma linfoplasmocitico), oppure diffuso e massivo, come nella LLC.
Dal punto di vista anatomo/clinico, possiamo distinguere
- infiltrazione interstiziale, con prevalente danno di tipo funzionale ed insufficienza renale spesso acuta, legata a possibile incremento della pressione intrarenale;
- infiltrazione glomerulare/vascolare, maggiormente associata a forme glomerulari con presenza di proteinuria spesso nefrosica.
I sintomi e segni più frequenti, anche se nel complesso molto rari rispetto a quelli sistemici, riflettono la presenza dell’infiltrazione da parte delle cellule linfomatose con gli effetti secondari ad essa legata: dolore al fianco, distensione addominale con talora massa palpabile, ipertensione da compressione vascolare, insufficienza renale, macroematuria occasionale, alterazioni urinarie caratterizzate da modesta proteinuria, qualche eritrocita e leucocita, rari cilindri e segni di sofferenza tubulare. Agli esami strumentali di solito, è apprezzabile incremento dimensionale dei reni, di solito bilaterale [1].
L'insufficienza renale acuta e l'aumento dimensionale bilaterale renale sono di solito considerati le manifestazioni caratteristiche dell'infiltrazione renale linfomatosa. Nonostante il coinvolgimento renale da infiltrazione linfomatosa sia relativamente frequente, l’IRA, come conseguenza dell'infiltrazione del linfoma renale, costituisce un'entità clinica non frequente (0,5%). Il meccanismo fisiopatologico sarebbe legato alla compressione acuta della componente tubulare e della microvascolatura renale secondario all'aumento della pressione interstiziale che porta all'ATN [1-3].
QUESITO DIAGNOSTICO: L’ASSENZA DI RICONOSCIUTA PROGRESSIONE EMATOLOGICA DELLA MALATTIA ESCLUDE L’IPOTESI DI COINVOLGIMENTO RENALE DA PARTE DELLA LLC ?
Dal punto di vista ematologico non tutti i pazienti affetti da LLC necessitano di trattamento specifico, che è indicato solo per popolazioni specifiche (vedi tab. 1).
La linfocitosi da sola, anche se estrema, non rappresenta indicazione per trattamento in pazienti che non hanno sintomi e che hanno una normale funzione del midollo osseo (Hb < 10 g/dl o una conta piastrinica < 100000/mmc sono di solito considerati come indicazioni per inizio del trattamento). Così come l’ipogammaglobulinemia o la presenza di paraproteinemia mono/oligoclonale da soli non costituiscono indicazioni per iniziare terapia.
Dal punto di vista renale, l'insufficienza renale acuta e l'aumento dimensionale bilaterale renale sono di solito considerati tra le manifestazioni caratteristiche dell'infiltrazione renale linfomatosa.
Il nostro paziente non presentava dati laboratoristici e strumentali che permettevano una diagnosi ematologica di malattia aggressiva: presente linfocitosi importante, ma senza segni di insufficienza del midollo osseo (Hb>10 g/dl e PLT > 100000/mmc). Era presente un peggioramento della funzione renale, ma in assenza di incremento dimensionale bilaterale.
Nei vari studi riportati in letteratura, non sempre la presentazione clinica e di laboratorio permette di evidenziare la presenza di interessamento renale; dal punto di vista strumentale le indagini radiologiche identificano anomalie renali solo in un terzo dei casi [1-6].
Le discrepanze tra i risultati radiologici e istologici possono essere spiegate dalla sensibilità dello strumento di radiologia, inferiore nelle prime fasi del coinvolgimento renale quando la morfologia degli organi è ancora preservata [6].
Alla luce di queste considerazioni la biopsia renale può migliorare significativamente le possibilità diagnostiche, la prognosi e il processo decisionale terapeutico. La biopsia mostra in genere infiltrazioni diffuse di linfociti monomorfi e conseguente compressione tubulare con NTA secondaria. Tubuli e glomeruli sono generalmente morfologicamente normali [3,6].
QUESITO TERAPEUTICO: QUALI TRATTAMENTO ED OUTCOME ATTESI?
La terapia del linfoma renale è la terapia ematologica della neoplasia linfatica. Il coinvolgimento renale non sembra influenzare la scelta della chemioterapia, specialmente per i sottotipi aggressivi. La sopravvivenza globale sembra essere correlata alla risposta ematologica [6].
In generale il recupero completo alla funzione di base non è frequente e dipende spesso anche dalla presenza di alterazioni croniche sottostanti [3,6].
Nel nostro caso, una volta ottenuto il referto dell’indagine preliminare, il paziente ha iniziato immediatamente terapia steroidea a dosaggio ematologico con rapida risposta dal punto di vista della funzione renale e della linfocitosi.
QUESITO GESTIONALE: QUALI SETTING E FOLLOW UP DEL PAZIENTE?
Dopo la esatta caratterizzazione istochimica dell’infiltrato linfoide (tab. 2) il paziente ha iniziato presso il Reparto di Ematologia terapia specifica con Ibrutinib, inibitore della tirosin chinasi di Bruton, usato in monoterapia sia nei pazienti naive che nei pazienti recidivanti/refrattari ala dose raccomandata per LLC (420mg pari a tre capsule, una volta al giorno), non necessario aggiustamento per funzione renale.
Agli ultimi esami di laboratorio, il paziente mostra una netta ripresa della funzione renale con creatinina di 1.22 mg/dl, (eGRF 61 ml/min/1.73mq), Hb 11,4 g/dl GB 15060/mmc, PLT 234000/mmc; i dati sono sicuramente confortanti anche se il breve periodo di osservazione non permette di esprimere giudizi prognostici quoad vitam e quoad valitudinem.
CONSIDERAZIONI GENERALI
Una visione specialistica monosettoriale rischia di sottostimare l’importanza di segni e sintomi a carico di organi diversi da quello di propria specifica pertinenza; in questo contesto la multidisciplinarità costituisce la base per un miglioramento dei risultati clinici. Nel caso descritto il coinvolgimento nefrologico (improcrastinabile visto il severo peggioramento funzionale) è stato essenziale nel percorso diagnostico e la biopsia renale ha permesso una corretta impostazione di una specifica terapia “ematologica”. È verosimile ipotizzare che in molti altri contesti ematologici cronici possa manifestarsi un coinvolgimento nefrologico non sempre ben evidenziato che potrebbe invece contribuire, quale criterio accessorio, ad una diversa impostazione terapeutica (altre forme linfoproliferative, MGUS). Lo studio funzionale renale e l’esame urine con l’eventuale coinvolgimento specialistico nefrologico costituiscono elementi di rilievo nel follow-up di questi pazienti.
La biopsia renale è una manovra cruenta non esente da rischi, soprattutto in presenza di alterazioni piastriniche; il suo impiego va proposto con maggior determinazione nel monitoraggio di pazienti onco-ematologici in presenza di variazioni funzionali renali o all’insorgere di significative alterazioni dell’esame urina.
BIBLIOGRAFIA
- Basso L et al. Il coinvolgimento renale nei linfomi. G Ital Nefrol 2010: 27(550):S34-S39
- Javaugue V et al. Clinicopathological spectrum of renal parenchymal involvement in B-cell lymphoproliferative disorders. Kidney Int. 2019 Jul;96(1):94-103
- Cohen LJ et al. The Spectrum of Kidney Involvement in Lymphoma: a Case Report and Review of the Literature Am J Kidney Dis. 2010 December ; 56(6): 1191–1196.
- Luciano RL et al. Kidney Involvement in Leukemia and Lymphoma. Advances in Chronic Kidney Disease, Vol 21, No 1 (January), 2014: pp 27-35
- Li Shi-Jun et al. Renal Involvement in Non-Hodgkin Lymphoma: Proven by Renal Biopsy. PLOS ONE | www.plosone.org April 2014 | Volume 9 | Issue 4 | e95190
- Corlu L et al. Renal Dysfunction in Patients With Direct Infiltration by B-Cell Lymphoma. Kidney International Reports (2019) 4, 688–697
- Hallek M, Cheson BD, Catovsky D, et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL. Blood 2018; 131:2745
TABELLE
Tabella 1. Criteri di malattia “attiva” secondo International Workshop on Chronic Lymphocytic Leukemia (iwCLL) [7].
|
La iwCLL definisce “malattia attiva” in presenza di uno o più dei seguenti criteri: |
|
|
|
|
|
|
a. Perdita di peso non intenzionale ≥ 10% entro i precedent 6 mesi b. Astenia importante (ie, ECOG PS ≤2; inabilità di lavorare o effettuare le attività usuali) c. Febbre >100.5°F o 38.0°C da ≥ 2 settimane senza evidenza di infezione d. Sudorazione notturna per ≥ 1 mese senza evidenza di infezione |
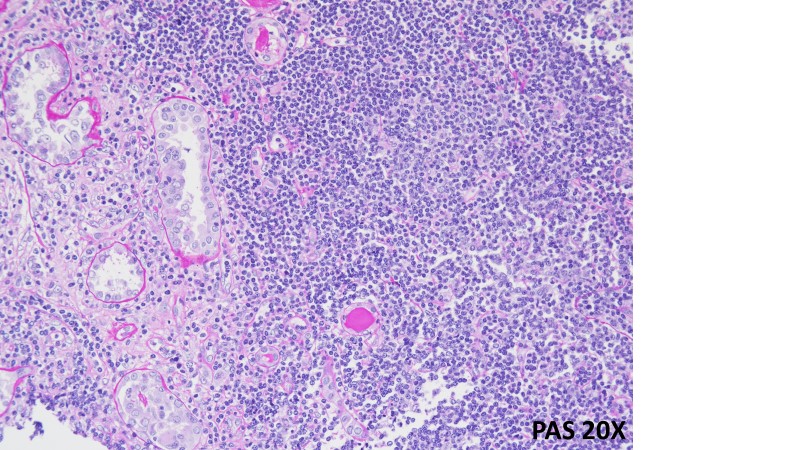
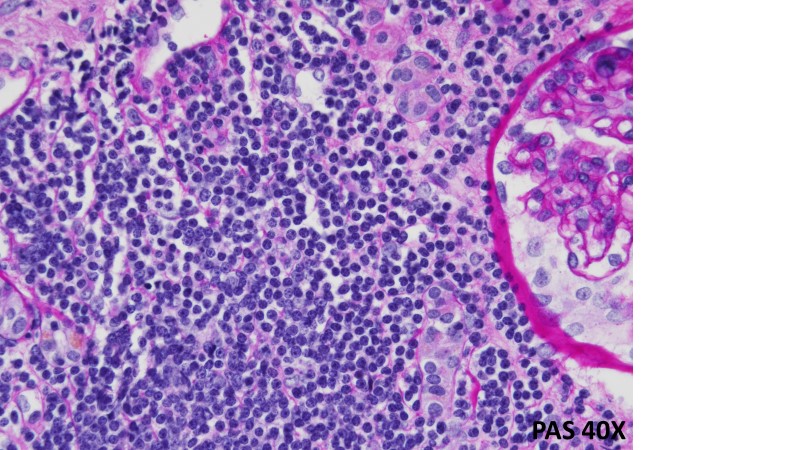
IMMAGINI DI BX RENALE: a sin colorazione PAS a ingrandimento 20x, a dx colorazione PAS a ingrandimento 40x: Corticale renale interessata da infiltrato linfoide diffuso, costituito da elementi di piccole dimensioni, con nucleo rotondeggiante, frammisti a elementi di maggiori dimensioni, sospetto per linfoma a piccoli linfociti
Tabella 2. REFERTO BIOPSIA RENALE. Lettura preparato istologico presso U.O. Anatomia Patologica, Ospedale S. Orsola-Malpighi di Bologna
