Attilio Olivieri, Erika Morsia
Dipartimento di Scienze Cliniche e Molecolari, Sezione Clinica Ematologica
Facoltà di medicina e chirurgia, Università Politecnica delle Marche


Introduzione
Il sangue costituisce l’essenza della vita e rispecchia in ogni dettaglio le alterazioni di organi apparentemente lontani. Esaminare il sangue costituisce da decenni lo strumento più immediato per risalire alle cause di uno stato morboso, di sintomi apparentemente inspiegabili con la clinica e l’imaging. Col passare degli anni le indagini sui campioni di sangue si sono moltiplicate ed hanno raggiunto livelli di sensibilità e di precisione inimmaginabili fino a qualche decennio fa. A partire dalla citogenetica, alla PCR per le malattie virali ed i marcatori tumorali, fino alla proteomica ed alla biopsia liquida: ormai qualche microlitro di sangue può consentirci di fare alcune diagnosi per le quali una volta era necessario un intervento chirurgico. Eppure tutto è iniziato da alcuni semplicissimi test, effettuati sulle due parti principali del sangue: l’emocromo ed il protidogramma.
In questo capitolo si parlerà dell’emocromo e dell’esame diretto delle cellule del sangue.
Il sangue, come sappiamo è un sistema bifasico costituito da una fase liquida, il plasma, formato da sali minerali e organici in soluzione, nella quale sono sospese cellule nucleate (globuli bianchi), non nucleate (globuli rossi) e frammenti citoplasmatici (piastrine). L’emopoiesi è un processo mediante il quale vengono prodotte le cellule del sangue e nell’adulto avviene nell’interstizio extravascolare del midollo osseo, nel quale sono residenti le cellule staminali totipotenti. Da queste ultime si differenziano i precursori non circolanti che, dopo maturazione, lasciano il parenchima attraverso l’endotelio fenestrato per emergere nei seni venosi e iniziare la loro vita nel circolo sanguigno.
GLI STRUMENTI DEL MESTIERE
1. Indagini quantitative sulle cellule del sangue periferico
L’esame emocromocitometrico è il test di pertinenza laboratoristica che ci permette di valutare le cellule circolanti nel sangue ed è di solito eseguito utilizzando strumenti automatizzati. Il referto che da ciò ne deriva deve riportare dati numerici universali, utili e facilmente interpretabili. I parametri usualmente compresi nell’emocromo completo automatizzato sono : RBC (red blood cells) ottenuto con elettro-ottica impedenziometrica; Hb (hemoglobin) con spettrofotometria; MCV (mean corpuscolar volume) e RDW (red distribution widht) con forward scatter; PLT (platelet count) con elettro-ottica impedenziometrica; WBC (white blood cells) con elettro-ottica impedenziometrica e DLC (differential leukocyte count) con forward scatter/ citochimica impedenziometrica/alta frequenza.
Tabella 1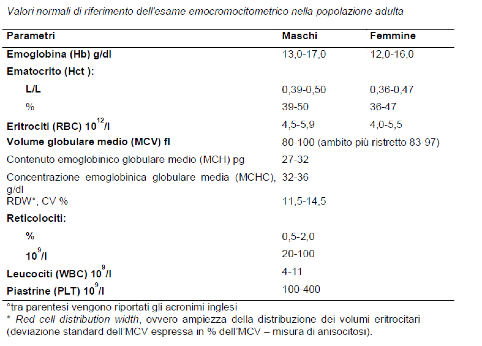
I globuli rossi, per svolgere la loro funzione di ossigenazione dei tessuti, devono mantenere le loro caratteristiche morfologiche e chimico- fisiche: forma a disco biconcavo; ambiente interno costante per mantenere l’emoglobina nella forma ridotta e un certo grado di elasticità per sopportare le sollicitazioni meccaniche nel microcircolo. La vita media di un globulo rosso viene valutata con tecniche isotopiche di incorporazione di cromo radioattivo ed è 120 giorni, al termine dei quali la cellula viene rimossa per obsolescenza dal circolo sanguigno tramite il processo di emacateresi operato dai macrofagi della milza, del fegato e del midollo osseo.
Lo studio della serie eritroide tramite l’esame emocromocitometrico avviene con al valutazione dei seguenti paramentri: RBC, conteggio dell’emoglobina e indici eritrocitari. L’acronimo RBC indica la concentrazione di globuli rossi per unità di volume di sangue periferico anticoagulato con EDTA-K3; la variabilità biologica di questo parametro è influenzata da: età e sesso, esercizio fisico e condizioni ambientali quali la diminuita pressione parziale dell’ossigeno che si osserva ad elevate altitudini. Il parametro RBC può essere determinato con metodi diretti come la microscopia ottica o con metodi indiretti tramite contatori elettronici di particelle o counters che misurano la luce dispersa dai globuli rossi isolati e immersi in flusso in misura proporzionale alle loro dimensioni. Dall’insieme delle misure dei volumi si ottiene l’MCV e il rapporto tra il grado di dispersione (deviazione standard) delle misure dei volumi intorno al valore centrale (MCV) e il valore medio permette il calcolo del coefficiente di variazione percentuale o indice di anisocitosi (RDW).
L’alterazione del parametro RBC ci può orientare su due condizioni: se è inferiore al valore target di normalità si parla di anemia e si può associare a sanguinamento cronico o acuto, distruzione dei globuli rossi, carenze nutrizionali, disordini o danni midollari, patologie infiammatorie croniche e insufficienza renale; se è superiore rispetto al valore target di normalità si parla di policitemia e può essere imputata a disidratazione, patologie infiammatorie polmonari, patologie oncologiche quali tumori del rene o altre formazioni eteroproduttive che secernono eritropoietina, abitudine tabagica, cause genetiche quali alterata sensibilità all’ossigeno, anomalie del rilascio dell’ossigeno emoglobinico e patologie clonali quali la policitemia vera.
L’alterazione del MCV può dare microcitosi (se <60 fl) imputabile ad esempio a carenza marziale o disordine talassemico o macrocitosi (se >120 fl) causata da un processo rigenerativo a carico dell’eritrone, carenza di vitamina B12 e folati o associata a disordini midollari mielodisplastici.
La determinazione dell’emoglobina si basa sull’utilizzo di contatori elettronici, sulla misura sprettrofotometrica a 540 nm dell’assorbanza dell’emolisato di un volume misurato del campione. Il valore centrale della distribuzione di frequenza degli indici di rifrazione misurati per un campione di globuli rossi rappresenta la concentrazione corpuscolare media dell’emoglobina (mean hemoglobin corpuscolar concentration, HCHM). L’ampiezza della distribuzione che corrisponde alla deviazione standard della distribuzione di frequenza rapportata al valore della media corrispondente rappresenta un indice di anisocromia (HDW). Se in un campione di sangue periferico aumenta il numero degli eritrociti con un basso contenuto di emoglobina corpuscolare si parla di ipocromia e si può presentare nella maggior parte delle forme di anemia acquisita o ereditaria; al contrario sono rare le condizioni di aumento della concentrazione di emoglobina corpuscolare come la sferocitosi ereditaria.
Gli altri indici eritrocitari vengono calcolati a partire dai precedenti parametri; i principali sono: MCH (mean corpuscolar hemoglobin) ottenuto dal rapporto tra il valore della concentrazione di Hb e il numero di globuli rossi e MCHC (mean corpuscolar hemoglobin concentration) ottenuto dal rapporto tra MCH e l’ematocrito. Il loro utilizzo principale è nella classificazione delle anemia.
Il conteggio dei reticolociti viene richiesto in caso di anemia per vedere se causata da eritropoiesi inefficace. I reticolociti sono i precursori diretti dei globuli rossi, fisiologicamente costituiscono una quota pari al 0,5-2% dei globuli rossi totali circolanti e da questi si distinguono per la presenza di mitocondri o loro frammenti e di sostanza basofila di natura ribosomiale. Possono essere riconosciuti tramite la colorazione con blu brillante di cresile o blu di metilene, che provocano al precipitazione del materiale ribosomiale sottoforma di fine reticolo (attualmente si usano anche colorazioni come acridina-orange). In numero di reticolociti può essere espresso in percentuale rispetto al numero di eritrociti circolanti, ma è preferibile correggere il valore moltiplicandolo per il rapporto tra Hct del paziente con Hct di riferimento dando così l’indice reticolocitario.
Si considera il valore di indice reticolocitario superiore a 2,5 come indicante una condizioni di anemia rigenerativa mentre se è inferiore a 1 indica una ipoplasia eritropoietica. Nelle anemie rigenerative (carenziali ed emorragiche), instaurando un adeguato rifornimento di elementi utili alla eritropoiesi, il conteggio incrementa e rimane superiore ai valori di riferimento finchè non si ripristina il normale contenuto di emoglobina; in presenza di eritropoiesi inefficace (anemie megaloblastiche, sindromi mielodisplastiche, talassemie) possono avvenire due fenomeni: una distruzione precoce delle cellule eritroidi nel midollo e alterazioni morfologiche e funzionali caratteristiche, come l’aumento della bilirubina indiretta. Nella condizione di midollo eritropoietico la risposta iperplastica del midollo con espansione dell’introne si accompagna a un conteggio di reticolociti depresso, poiché molti elementi non maturano a sufficienza e non raggiungono la circolazione periferica. Il conteggio delle piastrine (PLT) per unità di volume di sangue periferico anticoagulato con EDTA o citrato di sodio è uno dei parametri fondamentali dello studio dell’emostasi.
Le piastrine o trombociti sono frammenti cellulari che giocano un ruolo fondamentale nella coagulazione; l’esame emocromocitometrico ci permette di misurare il numero e la grandezza delle piastrine presenti nel campione. Il conteggio delle piastrine viene effettuato con contaglobuli automatici, ma dovrebbe essere confermato tramite l’osservazione dello striscio di sangue periferico colorato con May Grumwald Giemsa perché artefatti derivanti dalla frammentazione dei globuli rossi o la presenza di piastrine giovani e rigenerative di dimensioni elevate contribuiscono a falsi conteggi automatici. Inoltre nella fase preanalitica è di fondamentale importanza impedire la formazione di aggregati che possono causare in campioni con EDTA una falsa piastrinopenia.
Una diminuzione delle piastrine circolanti può derivare da un difetto midollare o da un aumento della distribuzione o del consumo periferico, ma al sintomatologia emorragica si ha solitamente per conteggi inferiori a 40.000/mm3. Il conteggio piastrinico può risultare diminuito in diverse condizioni patologiche quali infezioni virali (mononucleosi, morbillo, epatite), infezioni da Rickettsie, autoanticorpi contro le piastrine, utilizzo di alcuni farmaci (acetaminofene, chinino, sulfamidici), cirrosi, malattie autoimmuni, sepsi, neoplasie ematologiche come leucemie e linfomi, mielodisplasie, chemio e radioterapia. La presenza di una elevata conta piastrinica si può invece associare a patologia tumorali (tumore al polmone, gastrointestinale, seno, ovaio, …), artrite reumatoide, malattie infiammatorie intestinali, lupus eritematoso sistemico, anemia ferro carente, anemia emolitica o più raramente a un disordine mieloproliferativo quale trombocitemia essenziale.
La valutazione dei globuli bianchi nell’esame emocromocitometrico avviene tramite il conteggio dei globuli bianchi e la conta differenziale dei globuli bianchi. Il conteggio dei globuli bianchi si effettua tramite tecniche automatizzate di tipo elettro-ottico, dopo la lisi dei globuli rossi con saponina, i globuli bianchi vengono blandamente fissati con acido acetico diluito, mentre la misura dell’intensità della luce scatter ne fornisce le dimensioni. Con il termine leucopenia si indica la presenza di valori di globuli bianchi totali inferiori a 4000/mmc3, mentre il termine leucocitosi indica un aumento dei valori sopra a 10000/mmc3. La conta leucocitaria risulta utile nel monitoraggio dei pazienti emopatici, con processi infettivi acuti o cronici, per valutare la risposta terapeutica dopo chemioterapia o radioterapia. Le cause di leucocitosi sono molteplici, tra queste si annoverano emorragie, periodo postpartum, traumi, terapia steroidea, infiammazioni, condizioni allergiche come l’asma, esercizio fisico intenso e patologie ematologiche come la leucemia e i disordini mieloproliferativi. La leucopenia può essere causata da patologie midollari, malattie autoimmuni, sepsi, linfomi o altri tipi di tumore e patologie del sistema immunitario (ad esempio HIV). La conta differenziale dei globuli bianchi viene eseguita tramite lo studio dello striscio di sangue periferico.
2. Indagini qualitative sulle cellule del sangue periferico
Lo striscio di sangue permette di ottenere una sorta di fotografia, un'istantanea della popolazione cellulare presente in una goccia di sangue. Tramite lo striscio su vetrino è infatti possibile valutare il numero, la morfologia, lo stadio di maturazione e le percentuali numeriche di globuli rossi, leucociti e piastrine. Per l’esecuzione dello striscio può essere utilizzato sangue intero o contenente anticoagulante della provetta; la colorazione si effettua con la metodica di May-Grunwald-Giemsa nei paesi europei, mentre negli Stati Uniti si utilizza la colorazione di Wright. L’esame microscopico si effettua inizialmente a piccolo ingrandimento per una valutazione globale del preparato, che ci indica la leggibilità e la distribuzione dei leucociti e delle piastrine. Poi con un maggiore ingrandimento è possibile individuare le modificazioni di forma e di dimensioni dei globuli rossi, la morfologia dei leucociti con la valutazione della formula leucocitaria e la eventuale presenza di cellule anomale. Inoltre è possibile valutare la presenza di piastrine, la morfologia di queste e la possibile presenza di aggregati. In passato lo striscio di sangue periferico veniva effettuato quasi a tutti coloro che eseguivano un esame emocromocitometrico; esso rappresentava il metodo standard per valutare dimensioni, forma e struttura dei globuli rossi, l’identificazione del tipo e delle percentuali di globuli bianchi nonché per verificare una presenza di piastrine entro i range di normalità. Questo tipo di valutazione è stata ormai quasi del tutto sostituita dalle conte automatizzate. Quando, però, alla conta automatizzata o quando lo specialista sospetti anomalie a carico di globuli rossi, globuli bianchi o piastrine, lo striscio di sangue analizzato da un laboratorista esperto è ritenuto ancora oggi il miglior modo per valutare e identificare in modo corretto anormalità e immaturità delle cellule del sangue. In genere, l'esecuzione dello striscio segue un esame di prima linea, come l'emocromo, considerato sospetto.
Ad esempio, lo striscio di un soggetto affetto da anemia falciforme mostra la tipica conformazione a falce dei globuli rossi, che risultano invece troppo piccoli in caso di anemia microcitica e troppo grandi in presenza di anemia macrocitica. Grazie allo striscio di sangue è altresì possibile evidenziare la presenza di parassiti, come ad esempio quelli responsabili di malaria, filaria e malattia del sonno.
Lo studio della morfologia eritrocitaria permette di riconoscere la presenza di alterazioni morfologiche e tintoriali che la citometria in automazione non evidenzia perché valuta solo volumi e cromia corpuscolare. Le principali alterazioni sono: macrocitosi (diametro cellulare >8 um : anemie megaloblastiche, epatopatie gravi, ipotiroidismo); microcitosi ( diametro cellulare <6 um: anemia ferrocarenziale,talassemie, anemia da malattia cronica); ipocromia (area pallida centrale aumentata: contenuto di Hb diminuito); policromatofilia (presenza di globuli rossi non completamente emoglobinizzati : reticolocitosi); poichilocitosi (variabilità nella forma cellulare: anemia falcicorme, emolisi microangiopatica, leucemie, emopoiesi extramidollare, stress midollare), anisocitosi (variabilità nelle dimensioni cellulari: reticolocitosi, trasfusioni di sangue normale in condizioni di popolazioni cellulari micro o macrocitiche); leptocitosi (cellule a bersaglio: talassemie, ittero ostruttivo); sferocitosi (cellule prive dell’area pallida centrale: perdita di membrana, sferocitosi ereditaria, accellerata distruzione dei globuli rossi da parte del sistema reticolo endoteliale); schistocitosi (cellule frammentate: traumi meccanici intravascolari, emolisi microangiopatica); acantocitosi (superficie irregolarmente spinosa: anomalie del contenuto lipidico, elevate concentrazioni di acidi grassi liberi, , epatopatie; abetalipoproteinemia); echinocitosi( superficie regolarmente spinosa: uso di farmaci come barbiturici, salicilati, ecc, anomalie del contenuto lipidico, elevate concentrazioni di acidi grassi liberi, anormalità degli acidi biliari); stomatociti (area pallida centrale allungata a fessura: difetti ereditari di trasporto di membrana di sodio, gravi epatopatie); ellissociti (cellule ovali: anomalie ereditarie).
Con l’esame dello striscio si possono valutare anche il numero, le dimensioni, la morfologia ed il fenomeno degli aggregati piastrinici. I megatrombociti si riscontrano in diverse patologie congenite o non, che riguardano sia le piastrine (sindrome di Bernard-Soulier, piastrinopenia autoimmune, sindrome di Moschowitz, etc.) che il sistema emopoietico (sindromi mielodisplastiche, sindromi mieloproliferative croniche, etc.). Gli aggregati piastrinici possono essere espressione di un’alterazione legata all’anticoagulante presente nelle provette (EDTA), che causa una falsa riduzione del numero delle piastrine. La determinazione microscopica della conta differenziale dei leucociti permette sia il riconoscimento di alterazioni di forma e di dimensione, sia la valutazione quantitativa (valore relativo in %) delle singole classi leucocitarie. In un campione di sangue la partecipazione percentuale nella norma è la seguente: neutrofili 40-75%, linfociti 20-45%, monociti 0-8%, eosinofili 0-7% e basofili <1%.
Nei moderni citometri “a flusso” elettro-ottici il riconoscimento delle sottoclassi leucocitarie si fonda sull’analisi di due parametri cellulari: il volume corpuscolare misurato con light-scattering e il contenuto mieloperossidasi dei singoli leucociti.
In base al criterio dimensionale le cellule sono raggruppate in due classi: grandi cellule (linfociti attivati, grandi linfociti, monociti, neutrofili, eosinofili e basofili) e piccole cellule (piccoli linfociti), mentre il criterio citochimico le divide in perossidasi positive (neutrofili e eosinofili) e perossidasi negative (linfociti, monociti). I basofili sono riconosciuti per la loro tangibilità con l’alcian-blue o con la tecnica di decitoplasmazione con acido ftalico di Cremis-Orlik.
La conta dei neutrofili alterata viene definita neutropenia se < a 1.000/mmc e riconosce diverse cause tra cui infezioni gravi e diffuse, malattie autoimmuni, reazioni da farmaci, immunodeficienza, mielodisplasia, danno midollare e mieloftosi; quando la conta è > a 7.700/mmc si definisce neutrofilia e può essere dovuta a infezioni batteriche acute, infiammazione, necrosi tissutale, condizioni fisiologiche come stress e esercizio fisico intenso o emopatie come leucemia mieloide cronica.
Alterazioni della conta dei linfociti in difetto (linfopenia) si hanno nel caso di malattie autoimmuni (come lupus eritematoso sistemico, infezioni come HIV, epatiti, febbre tifica, danni midollari e uso di corticosteroidi); invece può risultare aumentata (linfocitosi) in caso di infezioni virali acute (CMV, EBV, HSV, rosolia,..), alcuni tipi di infezioni batteriche (pertosse, TBC), toxoplasmosi, infiammazioni croniche (come RCU) e emopatie come la leucemia linfatica cronica.
La monocitosi può essere dovuta a infezioni croniche (come TBC, infezioni fungine, endocarditi batteriche), patologie vascolari immunitarie (LES, sclerodermia, vasculiti, artrite reumatoide) ed emopatie come leucemia monocitico o mielomonocitica. Una bassa conta dei monociti di solito non è rilevante, se ripetuta nel tempo può essere indice di danno midollare o leucemia a cellule capellute.
L’iperosinofilia si può associare a condizioni allergiche come asma, febbre da fieno, reazioni a farmaci, infezioni parassitarie, malattie infiammatorie croniche e alcuni tipi di tumori; una elevata conta di basofili si può associare raramente a reazioni allergiche, infiammazione (come artrite reumatoide, rettocolite ulcerosa) e alcuni tipi di leucemia.
CONCLUSIONI
L’emocromo è l’esame di laboratorio più prescritto nella pratica medica; i parametri che ci fornisce questo test semplice, rapido ed economico, sono in grado di orientare in maniera universale ogni tipologia di atto medico o chirurgico: qualsiasi pratica invasiva, chirurgica o diagnostica, banale o complessa, non può prescindere dalla valutazione di un emocromo. L’emocromo è l’esame iniziale che viene eseguito ogni volta che un pa- ziente lamenta astenia o una sintomatologia sistemica, così come quando si reca in pronto soccorso per una sintomatologia acuta. Dalla valutazione dell’emocromo, un esame facilmente fruibile per tutte le discipline, inizia spesso l’albero decisionale della diagnostica medica e chirurgica, mentre l’esame morfologico dello striscio di sangue, oggi purtroppo sottoutilizzato, richiede una esperienza ed una competenza specialistiche, in grado di fornire indicazioni e dettagli unici non solo in ambito ematologico, ma in molti altri setting internistici (la ricerca di schistociti o di parassiti ne è un esempio). Questi due esami sono nati oltre un secolo fa e, con minime modificazioni, rappresentano tuttora lo strumento essenziale per inquadrare la maggior parte dei pazienti, immediatamente dopo la valutazione clinico-anamnestica, prima di molti altri test costosi e sofisticati.
Letture raccomandate
1. Morfologia delle malattie del sangue, G. D’Onofrio, G. Zini, Verduci Editore ISBN: 9788876208843 Pagine: 780 Edizione: Seconda Pubblicazione: 01/2013
2. Malattie del Sangue e degli Organi Emolinfopoietici, Sante Tura, Esculapio editore, 2015 ISBN: 9788874888849
3. Malattie del sangue e degli organi ematopoietici di Castoldi - Liso 2013
4. Wintrobe’s Clinical Hematology, 10th Edition
5. Hematology: Basic Principles and Practice, 1 set 2017 di Ronald Hoffman MD