All’inizio della drammatica esperienza della pandemia, la maggior parte degli esperti di emocoagulazione, incluso il sottoscritto, non avevano previsto un coinvolgimento così massiccio dei meccanismi della trombogenesi e della fibrinolisi nella fisiopatologia e nella clinica dell’infezione da Coronavirus. Certamente era chiaro che questi pazienti, affetti da sepsi, rientravano nella definizione di “soggetti ospedalizzati non chirurgici”, con malattia “medica” acuta e/o critica, e quindi erano da sottoporre a profilassi antitrombotica. Ben presto, però, le osservazioni informali provenienti dalle prime esperienze autoptiche anche di medici italiani, ed in seguito i risultati di studi osservazionali condotti specialmente in Olanda e in Francia, precisarono che nei pazienti con COVID-19 ricoverati in terapia intensiva (COVID di grado severo) l’incidenza di Malattia Venosa Tromboembolica (MVT) si attestava intorno al 30% dei casi, mentre l’Embolia Polmonare, sia secondaria a Trombosi Venosa profonda che apparentemente isolata, compariva in un numero allarmante di casi. Si può definire questa manifestazione come “reazione tromboembolica: Tipo 1”.
Tale elevata prevalenza di Malattia Venosa Tromboembolica (MVT) è però appannaggio, beninteso, dei pazienti con infezione severa, e pertanto ricoverati in strutture di terapia intensiva. Nei pazienti ammessi in Ospedale ma non in Terapia Intensiva tale prevalenza risulta invece tra il 6% e il 12%, quindi soltanto moderatamente elevata. Si deve inoltre sottolineare che, soprattutto nelle casistiche Europee, i casi di MVT sono comparsi nonostante la profilassi antitrombotica con Eparina a basso pm prescritta dalle Linee Guida riguardanti le malattie mediche acute o critiche, tra le quali le sepsi.
Ma, nei pazienti più gravi, si osserva anche un secondo tipo di reazione emocoagulativa che possiamo indicare come “reazione microtrombotica: Tipo 2”. Si tratta di un fenomeno di grave ed estesa microtrombosi, a prevalente ma non esclusiva localizzazione nel microcircolo polmonare, ove il recettore specifico per il virus è altamente concentrato. In tale sede la microtrombosi diffusa determina una grave sindrome di insufficienza respiratoria (ARDS, Acute Respiratory Distress Syndrome) che è il fattore più importante di letalità. La sindrome microtrombotica è potenzialmente sistemica, e può estendersi quindi anche ad altri organi (reni, fegato, sistema nervoso centrale, miocardio, arteriole periferiche). Può presentarsi come isolata, oppure associata alla Tromboembolia Polmonare classica, concomitante o in successione. Ed è proprio a questo punto che sorge la controversia: si tratta della ben nota Coagulazione Intravascolare Disseminata (CID), osservata anche nelle sepsi batteriche o virali, oppure siamo di fronte ad una sindrome coagulativa diversa, ben distinta dalla CID, e propria della malattia da COVID-19?
Se volessimo fermarci a considerazioni lessicali, potremmo proporci le seguenti domande, con le relative risposte: Questa Sindrome è basata: sulla COAGULAZIONE? - Sì
è INTRAVASCOLARE? - Sì
è DISSEMINATA? - Sì
Sarebbe dunque lapalissiano concludere che….…è una CID!
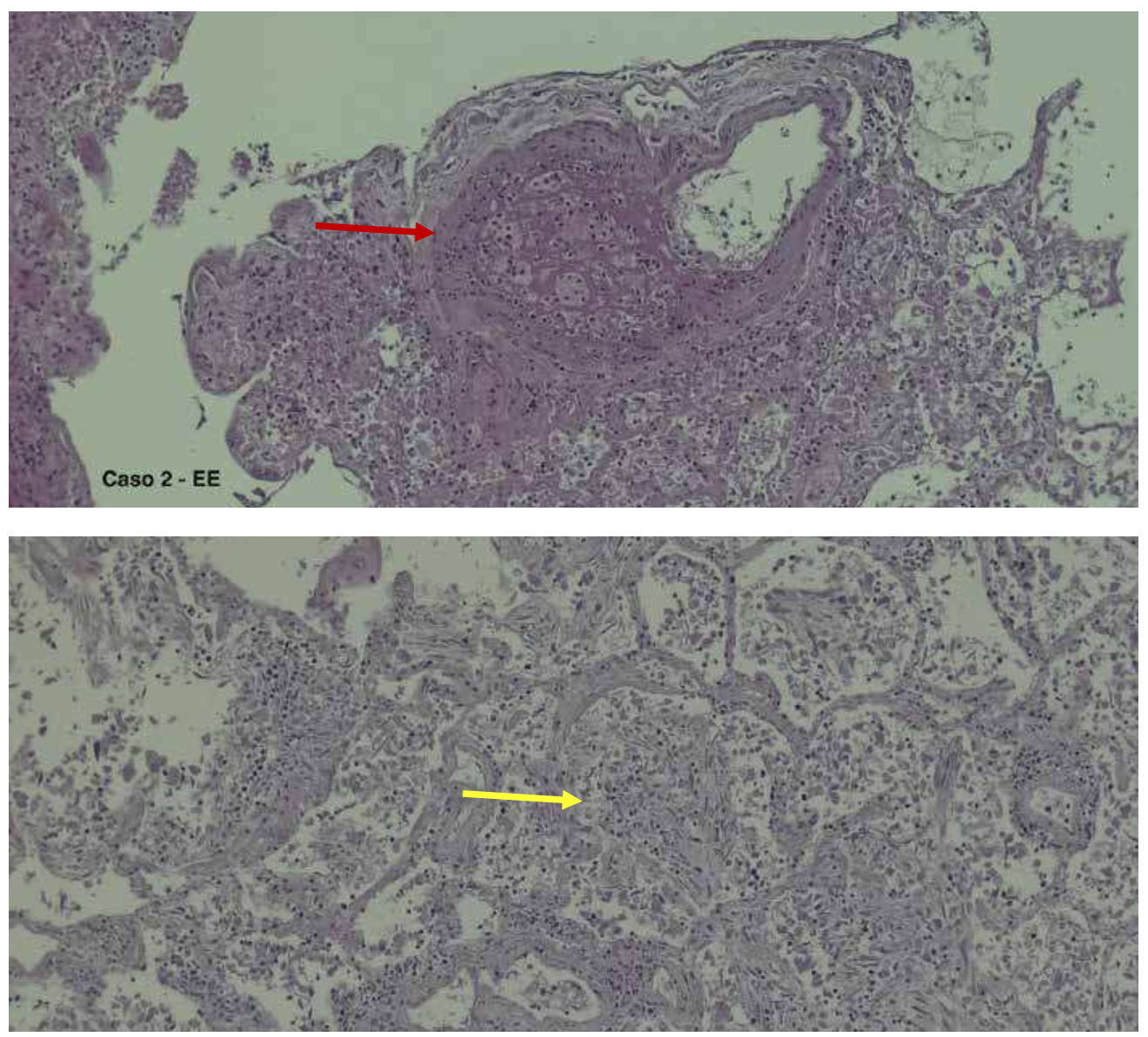
Ma osservando da vicino il recente grande flusso di letteratura sull’argomento, osserviamo che la reazione di Tipo 2, microtrombosi prevalentemente polmonare, presenta particolari caratteristiche: la distribuzione della microtrombosi è estensiva anzichè che regolata dal decorso delle arterie polmonari maggiori; il materiale che si trova negli spazi alveolari è costituito, oltre che da cellule ematiche, piastrine, fibrina, anche da immunoglobuline (IgG, IgA), e immunocomplessi, inclusa la frazione 3 del complemento. Si tratta dunque di una “vasculite microtrombotica” a componente sia emocoagulativa che immunitaria, a cui si associa un fenomeno di marcata e disordinata neo-angiogenesi a sviluppo endovascolare, che occlude gli alveoli determinando rottura delle membrane alveolari e microangiopatia peri-alveolare.
Queste particolari alterazioni morfo-funzionali non sembrano essere qualitativamente specifiche per la COVID19. Esse sono piuttosto conseguenza della estrema violenza dell’aggressione virale e della ugualmente intensa risposta immunitaria dell’ospite. Manifestazioni simili sono infatti state osservate anche in casi letali di altre malattie virali, in particolare da coronavirus. Alla violenza dell’aggressione virale il sistema immunitario risponde con la cosiddetta “tempesta citochinica”, che stimola la coagulazione non solo attraverso le vie consuete, come provato dallo spiccato aumento del D-dimero, ma anche attraverso vie accessorie, precostituite ma normalmente latenti.
Sebbene la definizione “tempesta citochinica” sia stata recentemente criticata, permane il concetto di uno stato iper-infiammatorio che si associa alla ipercoagulabilità ematica. Infatti, per la coagulopatia da COVID19 è stata proposta la denominazione di “immunotrombosi” o anche di “trombo-infiammazione”.
Oltre a questa visione della particolare componente immunologica dell’attivazione coagulativa, anche altre peculiarità vanno segnalate. A fronte di un parallelo aumento del D-dimero, nella Immuno-coagulopatia della COVID-19 il consumo di fibrinogeno, di altri fattori emocoagulativi, e delle piastrine è assai minore o addirittura assente; non vi sono segni di emolisi né vi è presenza di scistociti; e soprattutto manca l’attivazione generalizzata della fibrinolisi: vi sono infatti soltanto micro-emorragie locali negli alveoli polmonari, mentre sono assai rare le emorragie sistemiche.
Infatti, per la fibrinolisi, si segnala una duplice polarità: stimolazione della fibrinolisi attraverso la liberazione di Attivatore Tessutale del Plasminogeno (il tPA-endogeno), e concomitante inibizione della fibrinolisi attraverso l’aumento del suo principale inibitore, il PAI-I. La fibrinolisi funziona dunque ad un più elevato ma più instabile livello di base. Ma, nelle forme severe, l’inibitore PAI-I prende il sopravvento producendo il cosiddetto “fibrinolytic shutdown”, un’inibizione globale della fibrinolisi rivelata dalla trombo-elastografia, che determina accentuazione e stabilizzazione della microtrombosi.
Sono stati proposti anche altri meccanismi, ancor più lontani dalle proprietà di una classica CID. Si sono infatti osservate alcune corrispondenze del quadro microtrombotico della COVID-19 con una diversa entità morbosa, la Porpora Trombotica Trombocitopenica. In tale sindrome si osservano segni di anemia emolitica con scistociti, e piastrinopenia grave, con protrombina e fibrinogeno normali. Il danno endoteliale diffuso determina la formazione di grossi multimeri del Fattore von Willebrandt, che determinano la formazione di macro-aggregati piastrinici. Questa ipotesi può essere valida per singoli casi, ma al momento non è sufficientemente provata per poter contrastare la visione immuno-coagulativa di cui sopra.
In conclusione, la coagulopatia della infezione da COVID-19 può classificarsi come una distinta variante, con spiccate caratteristiche immunologiche, della abituale CID quale si verifica nei più comuni tipi di sepsi. I meccanismi immunologici e quelli emocoagulativi sono fortemente interconnessi così da definire tale coagulopatia appunto come una particolare variante della Coagulazione Intravascolare Disseminata.
Ripercussioni sulla Terapia
Dovendoci basare prevalentemente su esperienze osservazionali, al momento attuale possiamo soltanto avanzare alcune ipotesi di lavoro.
- La profilassi della trombosi con eparina a basso pm e a basso dosaggio sembra non essere in grado di prevenire la forma tromboembolica classica, e tanto meno la microtrombosi immuno-coagulativa propria della COVID19.
- La terapia antitrombotica (con eparina a piena dose terapeutica, o altri anticoagulanti) ha dato per ora risultati contraddittori, ma merita di essere riconsiderata con adeguati studi randomizzati.
- Abbiamo al momento solo dati sporadici sull’uso degli anticoagulanti orali indiretti o diretti (DOAC) sia in prevenzione che in terapia.
- Vista la complessa patogenesi della immuno-trombosi si può al momento raccomandare l’uso di anticoagulanti (soprattutto eparina) a dose terapeutica, ferma restando la fondamentale terapia con farmaci antivirali, anti-infiammatori, o modulatori delle reazioni immunitarie.
Si può quindi concludere la controversia patogenetica descritta in queste righe, affermando che la vasculopatia da COVID-19 comporta una marcata attivazione coagulativa, ma non è propriamente assimilabile alla CID. Ne costituisce invece una distinta variante, dovuta alla co-esistenza di importanti fattori di reattività immunologica dipendenti sia dal virus che dall’organismo “ospite”. Le conseguenze terapeutiche di tale complessa situazione morbosa sono ancora in gran parte da valutare.
Voci bibliografiche essenziali
- Ackermann M, Verleden SE, Kuehnel M et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in COVID19. NEJM 2020; 383:120-8.
- Hariri L, Hardin CC. Covid-19, Angiogenesis and ARDS endotypes. NEJM 2020; 383, 2, 182-183.
- Kwaan HC. Coronavirus disease 2019: the role of the fibrinolytic system from transmission to organ injury and sequelae. Semin Thromb Hemost 2020 doi 10.1055/s-0040-1709996.
- Marongiu F, Mameli A, Grandone E. et al. Pulmonary thrombosis: a clinical pathological entity distinct from pulmonary embolism? Semin Thromb Hemost 2019; 45(8):778-783.
- Schulman S. Coronavirus disease 2019, prothrombotic factors, and venous thromboembolism. Semin Thromb Hemost doi 10.1055/s0040-1710337.
Sergio Coccheri